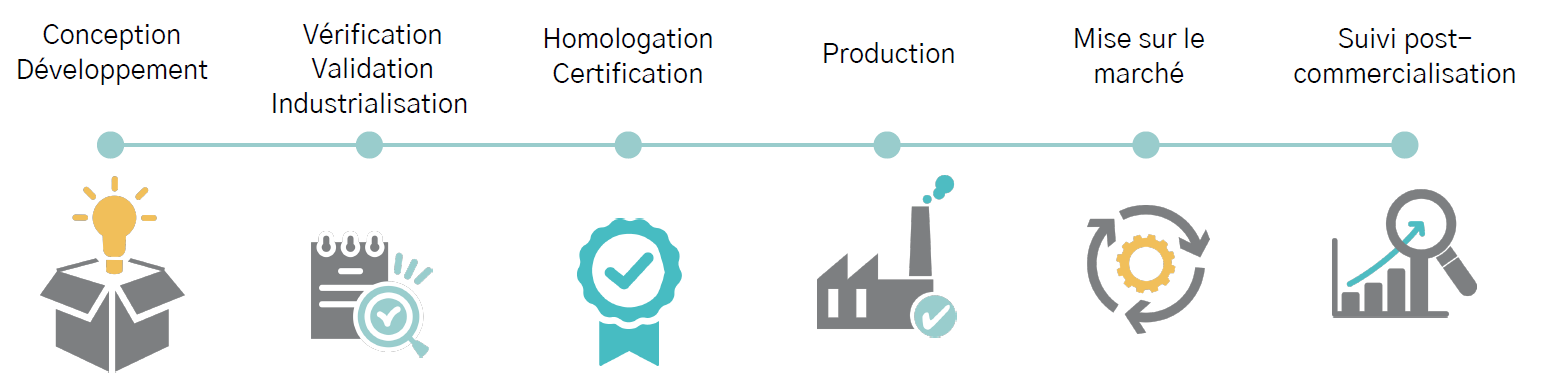
Optimisez la réussite à chaque étape du cycle de vie de vos dispositifs médicaux
Conseil
Grâce à une expertise reconnue dans le domaine des dispositifs médicaux, MedWay Consult propose un support complet tout au long du cycle de vie de vos dispositifs médicaux.
Affaires réglementaires & Qualité
L’élaboration de stratégies réglementaires et la constitution de la documentation technique nécessaire pour le marquage CE (MDR 2017/745) et l’enregistrement à l’international, et ce quelle que soit la classe de votre dispositif médical, sont prises en charge.
Les relations avec les organismes notifiés et les autorités compétentes sont facilitées par la préparation et la soumission des dossiers, la gestion des échanges avec ces acteurs, et la réponse aux demandes d’informations supplémentaires, assurant ainsi une navigation fluide et efficace à travers les processus réglementaires complexes et la mise en place d’une relation de confiance.
Medway Consult vous accompagne également dans la création et la gestion de la qualité de votre entreprise selon l’ISO 13485 et 21 CFR Part 820, s’assurant de l’efficacité du SMQ et en pilotant également les audits, la qualité fournisseurs et opérationnelle, ainsi que la gestion des non-conformités, CAPA, et réclamations.
De plus, MedWay Consult vous soutient dans vos audits de certification et inspections, avec une assistance détaillée et personnalisée. Cela inclut la formation du personnel, la préparation de la documentation requise, ainsi que l’aide pendant et après l’audit pour garantir la conformité et la réussite.

Conception & Industrialisation
Bénéficiez d’un accompagnement complet et personnalisé tout au long du processus de développement et de modification de vos dispositifs médicaux. Dès la phase de concept, une collaboration étroite avec vos équipes permet de définir les spécifications et les exigences réglementaires applicables, tout en s’assurant que le produit sera fabricable. L’élaboration de prototypes et la réalisation de tests approfondis pour vérifier et valider la fonctionnalité et la sécurité du dispositif sont également pilotés, incluant les évaluations de performance, de biocompatibilité et de stabilité.
Une gestion des risques rigoureuse est mise en place pour assurer non seulement la conformité réglementaire, mais aussi la sécurité des patients.
Le transfert en production est facilité en veillant à ce que tout le processus de fabrication soit optimisé et validé pour garantir productivité et robustesse. Cela comprend la formation du personnel, la maîtrise des procédés de fabrication et l’établissement de systèmes de contrôle de qualité robustes.
Des stratégies industrielles efficaces sont établies pour optimiser la production de vos dispositifs médicaux, en tenant compte des spécificités de votre entreprise.
L’approche inclut la définition et la validation rigoureuse des procédés de fabrication, garantissant leur efficacité, reproductibilité et conformité aux normes réglementaires, ainsi que la validation des systèmes informatisés et des méthodes de test.
Notre expertise permet de créer et valider des procédés de production robustes et optimisés, assurant une haute qualité de fabrication tout en respectant les délais et les coûts.
La réalisation de la documentation de conception et de production (DHF/DMR/DHR/VMP) est également proposée.

Optimisation des processus et Gestion de projet
Profitez d’une expérience éprouvée dans diverses organisations pour la mise en place, la gestion et l’implémentation de solutions innovantes visant à améliorer la productivité et optimiser la mise sur le marché de vos dispositifs médicaux.

Management de transition
Forte d’une expérience significative dans le secteur des dispositifs médicaux, en gestion d’équipe et en tant que membre de Comités de Direction (CODIR), cette prestation de management de transition répond aux besoins immédiats des entreprises.
Que ce soit pour un remplacement temporaire ou en attendant le recrutement du candidat idéal, cette offre permet d’assurer des fonctions de Manager ou Directeur en R&D, qualité, affaires réglementaires et industrialisation.
Les objectifs principaux sont les suivants :
– Maintenir une gestion efficace des équipes et projets en cours
– Garantir la qualité des processus et la conformité réglementaire
– Apporter une expertise stratégique au sein de la direction
– Optimiser les processus existants tout en respectant les objectifs de performance
Cette solution garantit une transition fluide, permettant à l’entreprise de rester focalisée sur ses priorités stratégiques, tout en assurant continuité et excellence opérationnelle durant la période de transition.

Les points forts de notre Expertise
Affaires réglementaires
- Mise en place de stratégie réglementaire
- Maîtrise approfondie du marquage CE et de la réglementation européenne applicables aux Dispositifs Médicaux (DDM 93/42/CEE, DDMIA 90/385/CEE, RDM 2017/745) pour toute classe de dispositif (classe I à classe III implantable)
- Constitution de dossiers techniques
- Enregistrement à l’International, notamment Canada, Etats-Unis, Brésil, Australie
- Maîtrise de la reportabilité et du relationnel avec les Organismes Notifiés et Autorités Compétentes
Qualité
- Maîtrise approfondie de l’ISO 13485 et 21 CFR Part 820
- Maintien d’un système de management de la qualité efficace
- Maîtrise des audits ISO 13485, marquage CE, MDSAP, inspections FDA
- Gestion de la qualité fournisseurs
- Expertise dans la qualité opérationnelle
- Gestion des non-conformités, CAPA et réclamations
Conception
- Maîtrise des Risques selon l’ISO 14971
- Mise en place et gestion du dossier de conception/DHF
- Validation de la stabilité et de la durée de vie des dispositifs médicaux
- Maîtrise des changements produits
- Vérification et Validation de la conception dont la biocompatibilité selon l’ISO 10993
Industrialisation
- Mise en place de stratégie industrielle
- Maîtrise et validation des procédés de fabrication
- Validation des systèmes informatisés
- Validation des méthodes de tests
- Maîtrise de la documentation (DMR/DHR/VMP)
- Maîtrise des changements des procédés de fabrication
Gestion de projet et optimisation des processus
Expertise dans la stratégie et la mise en place de solutions innovantes pour améliorer votre productivité et la mise sur le marché de vos dispositifs médicaux

